IS013485�R���T���^���g�b��@�@
ISO9001,ISO14001�F�؎擾
�@�X���[�v���T�|�[�g�������
ISO13485�Ɩ�@�@�x���R���T��
ISO�F�؎擾�R���T���e�B���O ���Z�L�����e�B
�R���T���e�B���O ���̑��K�i�����x��
�R���T���e�B���O
ISO�F�؎擾�x���R���T���e�B���O

ISO�R���T���^���g�F�g�b�v �� ISO13485�擾�x�� �� ISO13485�Ɩ�@�@
 ISO13485�Ɩ�@�@
ISO13485�Ɩ�@�@
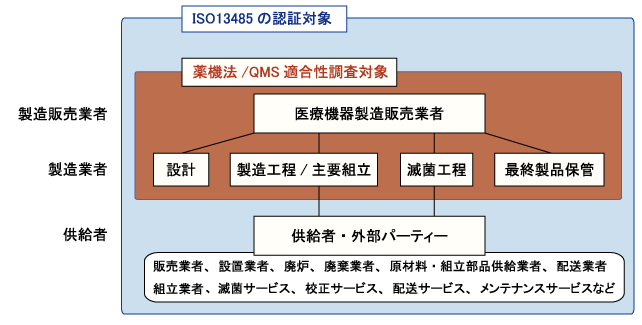
�@�����ň�Ë@����E�̔�����ׂɂ́A��@�@�i���@�F���i�A��Ë@�퓙�̕i���A�L�����y�ш��S���̊m�ۓ��Ɋւ���@���j�Ɋ�Â����̏��F���K�v�ł��B���̏��F�邽�߂ɂ́uQMS�ȗ߁v�i��Ë@��y�ё̊O�f�f�p���i�̐����Ǘ��y�ѕi���Ǘ��Ɋւ���ȗ߁j�Ɋ�Â��i���Ǘ����s�����̐R�����p�X����K�v������܂��B����QMS�ȗ߁i2021�N�����Łj���uISO13485:2016(JIS Q 13485:2018�j�̗v��������S�ʓI�Ɏ����ꂽ�����ł��BISO13485��QMS�ȗ߂Ɗ��S�Ɉ�v�Ƃ͂Ȃ�܂��A�p������{��ɖ����m�ɓ��{�Ɠ��̗v���������t���������m�i�p��̈Ⴂ���3�͂œ��{�Ǝ��̗v������������j�ł����{�͓����ƂȂ�܂��B�X���[�v���T�|�[�g��ISO13485�R�����i��ۗL����R���T�����ݐЂ��Ă�����I�ȃR���T���e�B���O�����{���܂��B
�@�����ň�Ë@����E�̔�����ׂɂ́A��@�@�Ɋ�Â����̏��F���K�v�ł��B��̓I�ɂ͓��{�ɂ������Ë@��̖@�K�̌n�͈ȉ��̂悤�ɂȂ�A�@���A���߁A�ȗ߁A�����A�ʒB�E�ʒm�APMDA�ʒB�ȂǂɂȂ�܂��BPMDA�Ƃ͓Ɨ��s���@�l ���i��Ë@�푍���@�\�̎��ł���A�����ɂ������@�@�̋K�����ǂŌ����J���ȂƂٖ͋��ȋ��͊W�ɂ���A���i�̌��N��Q�~�ρA���i���Ë@��Ȃǂ̕i���A�L��������ш��S���ɂ��āA�����O���珳�F�܂ł���т����̐��Ŏw���E�R�����i���F�R���j�A�s�̌�ɂ�������S���Ɋւ�����̎��W�A���́A���s���i���S��j���Ƃ�ʂ��āA�����ی��̌���ɍv�����邱�Ƃ�ړI�Ƃ��Ă��܂��B
| �@ | �@ | |
| �@ |
�yQMS�ȗ߁z
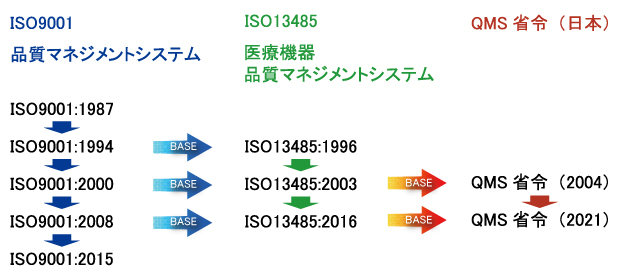
�@��L�̗l�ɁA��ɍ����ň�Ë@����E�̔�����ׂɂ́A��@�@�i���@�F���i�A��Ë@�퓙�̕i���A�L�����y�ш��S���̊m�ۓ��Ɋւ���@���j�Ɋ�Â����̏��F���K�v�ł��B�㕔�̖@���Ƃ��Ė�@�@������A��̓I�Ȋ������������߂̈�Ƃ��ďȗ߂�����킯�ł��B���̏ȗ߂̒��ł����ɏd�v�Ȃ̂��uQMS�ȗ߁v�i��Ë@��y�ё̊O�f�f�p���i�̐����Ǘ��y�ѕi���Ǘ��Ɋւ���ȗ߁j�ł���A�����ł̈�Ë@��̐����̔����F��A�����̔��F�̗v���Ƃ��ēK�p����܂��B�g�D�́AQMS�ȗ߂Ɋ�Â��i���Ǘ��V�X�e�����\�z�A��Ë@��̕i�����Ǘ����A�T�N���o�߂��邲�ƂɁuQMS�K���������v�������ƂɂȂ�܂��B����QMS�ȗ߂��uISO13485:2016(JIS Q 13485:2018�j�̗v��������S�ʓI�Ɏ����ꂽ�����ł��BiSO13485��QMS�ȗ߂Ɗ��S�Ɉ�v�Ƃ͂Ȃ�܂��A�p������{��ɖ����m�ɓ��{�Ɠ��̗v���������t���������m�i�p��̈Ⴂ���3�͂œ��{�Ǝ��̗v������������j�ł����{�͓����ł��B�̂ɁAISO13485�̔F���擾����i����j�Ɩ�@�@�Ɋ�Â����̐R���͊�{�I�Ɂu���ސR���v�����ōς݂܂��B�Ȃ��AISO9001��ISO13485�AQMS�ȗ߂̊W�͈ȉ��̐}�̂悤�ɂȂ�܂��B
�y��Ë@��̕��ށz
�@���E�e���ł́u��Ë@��v�̒�`���قȂ�A�e���Ǝ��ň�Ë@����`�����x���������܂��B��Ë@��͍��ۓI�ɂ͐l�̂ɗ^����e���ɉ�����4�ɕ��ށi�N���X�T�`�N���X�W�j���Ă��܂����A�䂪���ɂ������@�@�ł�3�̃N���X�ɕ��ށi���x�Ǘ���Ë@��A�Ǘ���Ë@��A��ʈ�Ë@��j���܂��B
|
|||||||
| �@ |
|||||||
�@����̉�����ISO13485��F�؎擾����Ό����Ƃ���QMS�ȗ߂̎��n�������Ȃ��Ă��ǂ����ƂɂȂ�܂��i���ސR���j�B�]����QMS�ȗߌ����́APMDA�A�s���{���A��O�ҋ@�ւ̎O�҂ōs���AISO13485�F���擾���Ă�QMS�ȗߌ�������K�v������܂����B����̉����Ō������{�҂�PMDA�Ƒ�O�ҋ@�ւɂȂ�A�܂��AISO13485�F���擾�����PMDA�̎��n�����͍s���Ȃ��ׁA���ɑg�D�ɂƂ��Ă�ISO13485���F���₷���Ȃ鎖�ŃO���[�o���W�J�����Ղɂ��Ă��܂��B
�yGVP�ȗ߁z
�@GVP�ȗ߁i�u�����̔�����S�Ǘ��̊�iGood Vigilance Practice�FGVP�j�v�Ƃ́A��Ë@�퓙�̐����̔���̈��S�Ǘ���ŁA�i���E�L�����y�ш��S���Ɋւ��鎖�����̑��K���Ȏg�p�̂��߂ɕK�v�ȏ��̎��W�A�����y�т��̌��ʂɊ�Â��K�v�ȑ[�u�̕��@���߂����̂ł��BGvp�ȗ߂ł́A�s�̌�̈��S�Ǘ����m���ɂ��邽�߂ɓK�ȗ͗ʂ������S�Ǘ��ӔC�҂̔C�������߂Ă��܂��B
�@�O���[�o���ȋK�i�ł���uISO�v�Ɗe���̖�@�@���قȂ�悤��ISO13485��QMS�ȗ߂̑Ώۑg�D�͈قȂ�܂��BQMS�ȗ߂̑ΏۂŖ����Ă�ISO13485�͔F�ł���ꍇ������܂��B�i��F�����ł͈�Ë@��̃J�e�S���[�ɓ���Ȃ��Ă��A���O�ł́u��Ë@��v�Ƃ��ė��p����Ă���j

�S���̊e�����̂ɂ������ʗp���i�̔����x�ɌW����E���k�����ꗗ [193KB] �͂�����
http://www.mhlw.go.jp/bunya/iyakuhin/ippanyou/pdf/madoguchi.pdf
��ʗp���i�̔����x�͂�����
http://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/
iyakuhin/ippanyou/index.html?PHPSESSID=a5dcda4f308129344623805923cf36d6
�@ISO13485�F�̋y��QMS�ȗߑΉ��R���T���e�B���O�͐���X���[�v���T�|�[�g�ւ��C�����������B��C�̃R���T���^���g���e�ؒ��J�ɑg�D��ISO13485�F�ւƎw�����܂��B�܂�TPS�ł�ISO 14971 ���X�N�}�l�W�����g�Z�~�i�[�����{���Ă��܂��B
���@�uISO13485�R���T���e�B���O���сv��������
���@�uISO13485���������Z�~�i�[�v�ˁ@�\�����݂�������
���@�uISO13485�R���T���e�B���O���ψ˗��v�ˁ@�\�����݂�������


HOME�@ISO13485�Ƃ��@ISO13485�擾�̃����b�g�@ ISO13485�擾�x���T�[�r�X�@ISO13485�擾�t���[�@ ISO�F�؎擾�ɕK�v�Ȕ�p



�����{��
��101-0051
�����s���c��_�c�_�ے�3-25-11
�쏕��i�r�� 7F
TEL 03-3263-4521
FAX 03-3263-4522

���I�t�B�X
��540-0012
���{���s������J��3-4-5
���A���C�Y�J���r���@7F
TEL 06-6949-0550
FAX 06-6949-0551

�����I�t�B�X
��812-0023
�����������s������ޗlj���14-20
�x�X�g�唎�r���V�e
TEL 092-403-5900
FAX 092-403-5901
�X���[�v���T�|�[�g�������
�T�e���C�g�R���T���^���g�@
�k�C���A���A�_�ސ�A��t�A���É��A���s�A�����A���ɁA�L���A�R���A�F�{�A����A�{��A����